Lyrica
Indicaţii terapeutice, doze şi mod de administrare

Lyrica 75 mg/150 mg/300 mg, capsule - Indicaţii terapeutice, doze şi mod de administrare1

Indicaţii terapeutice:
- Durere neuropată: Lyrica este indicat pentru tratamentul durerii neuropate periferice şi centrale la adulţi (DNeP);
- Epilepsie: Lyrica este indicat ca tratament asociat, la adulţii cu convulsii parţiale, cu sau fără generalizare secundară;
- Tulburare anxioasă generalizată: Lyrica este indicat pentru tratamentul tulburării anxioase generalizate (TAG) la adulţi.
Doze şi mod de administrare
Doze: Doza variază între 150 şi 600 mg pe zi administrată în 2 sau 3 prize.
- Durere neuropată: Tratamentul cu pregabalin poate fi iniţiat cu o doză de 150 mg pe zi administrată fracţionat în două sau trei prize. În funcţie de răspunsul individual şi de tolerabilitatea pacientului, doza poate fi crescută la 300 mg pe zi după un interval de 3 până la 7 zile şi, dacă este necesar, până la doza maximă de 600 mg pe zi, după încă un interval de 7 zile.
- Epilepsie: Tratamentul cu pregabalin poate fi iniţiat cu o doză de 150 mg pe zi administrată fracţionat în două sau trei prize. Pe baza răspunsului individual şi pe tolerabilitatea pacientului, doza poate fi crescută la 300 mg pe zi după o săptămână. Doza maximă de 600 mg pe zi poate fi atinsă după încă o săptămână.
- Tulburare anxioasă generalizată: Doza variază între 150 şi 600 mg pe zi, administrată în 2 sau 3 prize. Necesitatea tratamentului trebuie reevaluată regulat.
Tratamentul cu pregabalin trebuie iniţiat cu 150 mg pe zi. În funcţie de răspunsul şi tolerabilitatea individuale, doza poate fi crescută la 300 mg pe zi după un interval de 1 săptămână. După încă 1 săptămână, doza poate fi crescută la 450 mg pe zi. După încă o săptămână se poate ajunge la doza maximă de 600 mg pe zi.
Întreruperea tratamentului cu pregabalin
În conformitate cu practica clinică actuală, dacă tratamentul cu pregabalin trebuie întrerupt, se recomandă ca acest lucru să fie făcut treptat, timp de minim o săptămână, indiferent de indicaţie.
Insuficienţă renală
Pregabalinul se elimină din circulaţia sistemică în primul rând prin excreţie renală, sub formă de medicament netransformat. Deoarece clearance-ul pregabalinului este direct proporţional cu clearance-ul creatininei, reducerea dozei la pacienţii cu afectarea funcţiei renale trebuie individualizată în concordanţă cu clearance-ul creatininei (CLcr), după cum se prezintă în Tabelul 1 şi determinat conform următoarei formule:

Pregabalinul se elimină în mod eficace din plasmă prin hemodializă (50% din medicament în 4 ore). Pentru pacienţii hemodializaţi, doza zilnică de pregabalin trebuie ajustată pe baza funcţiei renale. În completarea dozei zilnice, trebuie administrată o doză suplimentară imediat după fiecare 4 ore de şedinţă de hemodializă (vezi Tabelul 1).
Tabelul 1. Ajustarea schemei terapeutice cu pregabalin pe baza funcţiei renale
| Clearance-ul creatininei (CLcr) (ml/min) | Doza totală de pregabalin* | Schema terapeutică | |
| Doza de iniţiere(mg/zi | Doza maximă (mg/zi) | ||
| ≥ 60 | 150 | 600 | BID sau TID |
| ≥ 30 - < /> | 75 | 300 | BID sau TID |
| ≥ 15 - < /> | 25 – 50 | 150 | O dată pe zi sau BID |
| Suplimentarea dozei după hemodializă (mg) | |||
| 25 | 100 | Doza unică+ | |
TID = divizată în trei prize; BID = divizată în două prize
* Doza totală de pregabalin (mg/zi) trebuie divizată în funcţie de regimul de administrare, exprimat în mg/doză
+ Doza suplimentară este unică
Insuficienţă hepatică
Nu este necesară ajustarea dozelor la pacienţii cu insuficienţă hepatică.
Copii şi adolescenţi
Siguranţa şi eficacitatea administrării Lyrica la copii cu vârsta sub 12 ani şi adolescenţi (între 12 şi 17 ani) nu au fost stabilite.
Vârstnici
La pacienţii vârstnici este necesară reducerea dozei de pragabalin din cauza scăderii funcţiei renale, scăderea clearance-ului oral al pregabalinului fiind paralelă cu scăderea clearance-ului creatininei, asociată cu înaintarea în vârstă (vezi Tabelul 1).
Mod de administrare
Lyrica poate fi administrat cu sau fără alimente. Lyrica este numai pentru administrare orală.
Pentru informații detaliate de prescriere, consultați Rezumatul Caracteristicilor Produsului.
Referinţe:
- Rezumatul caractecteristicilor produsului Lyrica®
LYR-2023-1433
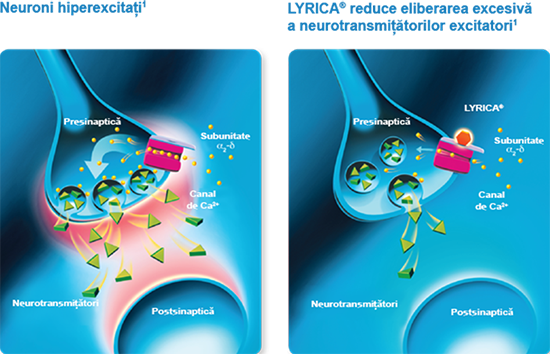
Mecanism de acţiune
LYRICA® reduce eliberarea excesivă a neurotransmițătorilor excitatori.1
LYRICA® se leagă selectiv cu afinitate ridicată de subunitatea α2-δ a canalelor de calciu voltaj-dependente din sistemul nervos, atenuând influxul de calciu.1,2
Kavoussi R. Pregabalin: from molecule to medicine. Eur Psychopharmacol. 2006
Neurotransmisia hiperactivă a neuronilor care eliberează substanța P, glutamat și norepinefrină este restabilită la starea fiziologică normală.1
Referinţe:
- Kavoussi R. Pregabalin: from molecule to medicine. Eur Psychopharmacol. 2006;16 (suppl 2):S128-S133.
- Lyseng-Williamson K, Siddiqui A. Pregabalin: a review of its use in fibromyalgia. Drugs. 2008;68(15):2205-2223.
LYR-2023-1433
Siguranţă şi tolerabilitate

Atenţionări şi precauţii speciale pentru utilizare1
Pacienţi cu diabet zaharat: unii pacienţi cu diabet zaharat care au prezentat creştere ponderală în timpul tratamentului cu pregabalin pot necesita ajustarea dozelor medicamentelor hipoglicemiante.
Reacţii de hipersensibilitate: au fost raportate reacţii de hipersensibilitate, inclusiv cazuri de angioedem. Dacă apar simptome de angioedem de exemplu edem facial, perioral sau al căilor aeriene superioare, tratamentul cu pregabalin trebuie întrerupt imediat.
Reacții adverse cutanate severe (RACS): în asociere cu tratamentul cu pregabalină, s-au raportat rar reacții adverse cutanate severe (RACS), inclusiv sindrom Stevens-Johnson (SSJ) și necroliză epidermică toxică (NET), care pot pune viața în pericol sau pot fi letale. Dacă apar semne și simptome care sugerează aceste reacții, pregabalina trebuie retrasă imediat și trebuie luat în considerare alt tratament (după caz).
Ameţeală, somnolenţă, pierderea conştienţei, confuzie şi afectare mentală: tratamentul cu pregabalin s-a asociat cu ameţeală şi somnolenţă, care pot creşte incidenţa leziunilor accidentale (căderi) la populaţia vârstnică. Pacienţii trebuie avertizaţi să fie prudenţi până când se obişnuiesc cu posibilele reacţii adverse la medicament.
Efecte asupra vederii: au fost raportate reacţii adverse vizuale, inclusiv pierderea vederii, înceţoşarea vederii sau alte modificări ale acuităţii vizuale, dintre care multe au fost tranzitorii. Întreruperea tratamentului cu pregabalin poate duce la dispariţia sau reducerea acestor simptome vizuale.
Insuficienţă renală: au fost raportate cazuri de insuficienţă renală, iar întreruperea tratamentului cu pregabalin, în câteva cazuri, a demonstrat reversibilitatea acestei reacţii adverse.
Insuficienţǎ cardiacǎ congestivă: au fost de cele mai multe ori raportate la pacienţi în vârstă, cu funcţie cardiovasculară compromisă şi cărora li s-a administrat pregabalin pentru durerea neuropată. Pregabalin trebuie utilizat cu precauţie la aceşti pacienţi. Reacţia adversă poate să dispară la întreruperea tratamentului cu pregabalin.
Tratamentul durerii neuropate centrale apărute din cauza traumatismului măduvei spinării: incidenţa reacţiilor adverse în general, a reacţiilor adverse la nivelul sistemului nervos central şi în special a somnolenţei a fost crescută.
Deprimare respiratorie: pacienții cu funcție respiratorie compromisă, boală respiratorie sau neurologică, insuficiență renală, utilizare concomitentă de sedative ale SNC și vârstnicii pot avea un risc mai mare de a prezenta această reacție adversă severă. Pot fi necesare ajustări ale dozei la acești pacienți.
Ideaţie suicidară şi comportament suicidar: au fost raportate la pacienţii trataţi cu medicamente antiepileptice în câteva indicaţii.
Scădere a funcţiei tractului gastro-intestinal inferior: au fost raportate evenimente legate de scăderea funcţiei tractului gastrointestinal inferior (de exemplu, obstrucţie intestinală, ileus paralitic, constipaţie) atunci când pregabalin a fost administrat concomitent cu medicamente care pot induce constipaţia, precum analgezicele opioide.
Utilizare concomitentă cu opioide: se recomandă prudenţă în cazul prescrierii pregabalin concomitent cu opioide din cauza riscului de deprimare a SNC.
Administrare incorectă, potenţial de abuz sau dependenţă: pregabalin poate provoca dependenţă de medicament, care poate să apară la doze terapeutice. Înainte de a prescrie pregabalin, trebuie evaluat cu atenţie riscul pacientului de administrare incorectă, abuz sau dependenţă.
Simptome de întrerupere: Au fost raportate următoarele simptome: insomnie, cefalee, greaţă, anxietate, diaree, sindrom gripal, nervozitate, depresie, ideaţie suicidară, durere, convulsii, hiperhidroză şi ameţeli. Dacă administrarea de pregabalin trebuie întreruptă, se recomandă ca acest lucru să fie făcut în mod treptat, în timp de minimum 1 săptămână, indiferent de indicaţie.
Encefalopatie: au fost raportate cazuri de encefalopatie.
Intoleranţă la lactoză: Lyrica conţine lactoză monohidrat. Pacienţii cu afecţiuni ereditare rare de intoleranţă la galactoză, deficit de lactază Lapp sau malabsorbţie la glucoză-galactoză nu trebuie să utilizeze acest medicament.
Conţinutul de sodiu: Lyrica conţine mai puţin de 1 mmol de sodiu (23 mg) per capsulă. Pacienţii care urmează o dietă săracă în sodiu pot fi informaţi că acest medicament este practic „fără sodiu”.
Interacţiuni cu alte medicamente şi alte forme de interacţiune
Contraceptive orale noretisteronă şi/sau etinilestradiol: Administrarea concomitentă a pregabalinului cu contraceptivele orale noretisteronă şi/sau etinilestradiol nu influenţează farmacocinetica la starea de echilibru a niciuneia dintre substanţe.
Medicamente cu acţiune asupra sistemului nervos central: Pregabalin poate amplifica efectele etanolului şi lorazepamului.
În cadrul supravegherii după punerea pe piaţă, există raportări de insuficienţă respiratorie, comă şi decese la pacienţii trataţi cu pregabalin concomitent cu opioide şi/sau alte medicamente cu efect deprimant asupra sistemului nervos central (SNC). Pregabalinul pare să aibă efect aditiv în tulburările funcţiei cognitive şi a funcţiei motorii grosiere induse de către oxicodonă.
Fertilitatea, sarcina şi alăptarea
Femeile aflate la vârsta fertilă trebuie să folosească metode contraceptive eficace pe durata tratamentului. Pregabalin poate traversa placenta la om. Nu trebuie utilizat în timpul sarcinii, exceptând cazul în care beneficiul terapeutic matern depăşeşte net riscul potenţial pentru făt. Pregabalinul se excretă în laptele uman. Nu sunt disponibile date clinice privind efectele pregabalin asupra fertilităţii la femei. După 3 luni de tratament, nu au existat efecte asupra motilităţii spermatozoizilor.
Efecte asupra capacităţii de a conduce vehicule şi de a folosi utilaje
Lyrica poate avea o influenţă minoră sau moderată asupra capacităţii de a conduce vehicule sau de a folosi utilaje. Pacienţii trebuie avertizaţi să nu conducă vehicule, să nu folosească utilaje complexe sau să nu se implice în alte activităţi potenţial periculoase.
Reacţii adverse
Foarte frecvente: ameţeală, somnolenţă, cefalee.
Frecvente: rinofaringită, apetit crescut; stare de euforie, confuzie, iritabilitate, dezorientare, insomnie, libido scăzut; ataxie, tulburări de coordonare, tremor, dizartrie, amnezie, tulburări de atenţie, parestezii, hipoestezii, sedare, tulburări de echilibru, letargie; vedere înceţoşată, diplopie; vertij; vărsături, greaţă, constipaţie, diaree, flatulenţă, distensie abdominală, xerostomia; disfuncţie erectilă; crampe musculare, artralgii, dureri lombare, dureri la nivelul membrelor, spasm cervical; edeme periferice, edeme, mers anormal, căzături, senzaţie de ebrietate, stare de rău, fatigabilitate; creştere a greutăţii corporale.
Mai puţin frecvente: neutropenie, hipersensibilitate; anorexie, hipoglicemie; halucinaţii, atac de panică, nelinişte, agitaţie, depresie, comportament depresiv, stare de exaltare, agresivitate, labilitate emoţională, depersonalizare, găsirea cu dificultate a cuvintelor, vise anormale, libido crescut, anorgasmie, apatie; sincopă, stupor, mioclonii, pierdere a conştienţei, hiperactivitate psihomotorie, dischinezie, ameţeală ortostatică (posturală), tremor intenţional, nistagmus, tulburări cognitive, afectare mentală, tulburări de vorbire, hiporeflexie, hiperestezie, senzaţie de arsură, ageuzie, stare generală de rău; pierdere a vederii periferice, tulburări vizuale, tumefiere oculară, afectare a câmpului vizual, reducere a acuităţii vizuale, dureri oculare, astenopie, fotopsie, xeroftalmie, hiperlacrimaţie, iritare ocular; hiperacuzie; tahicardie, bloc atrioventricular de gradul I, bradicardie sinusală, insuficienţă cardiacă congestive; hipotensiune arterială, hipertensiune arterială, bufeuri, congestie facială, extremităţi reci; dispnee, epistaxis, tuse, congestie nazală, rinită, sforăit, uscăciune nazală; reflux gastro-esofagian, hipersecreţie salivară, hipoestezie orală; valori mari ale enzimelor hepatice*;
erupţii cutanate papulare, urticarie, hiperhidroză, prurit; tumefieri articulare, mialgii, spasme musculare, durere cervicală, rigiditate musculară; incontinenţă urinară, disurie; disfuncţie sexuală, ejaculare întarziată, dismenoree, dureri la nivelul sânului; edem generalizat, edem facial, senzaţie de apăsare în piept, durere, pirexie, sete, frisoane, astenie; creştere a valorilor serice ale creatinfosfokinazei, creştere a valorilor glicemiei, scădere a numărului de trombocite, creştere a creatininemiei, scădere a potasemiei, scădere a greutăţii corporale.
Rare: angioedem, reacţii alergice; dezinhibiţie, comportament suicidar, ideație suicidară; convulsii, parosmie, hipochinezie, disgrafie, parkinsonism; pierdere a vederii, keratită, oscilopsie, modificare marcată a percepţiei vizuale, midriază, strabism, perceperea de imagini strălucitoare; prelungire a intervalului QT, tahicardie sinusală, aritmie sinusală; edem pulmonar, constricţie la nivelul gâtului; ascită, pancreatită, umflare a limbii, disfagie; icter; necroliză epidermică toxică, Sindrom Stevens Johnson, transpiraţii reci; rabdomioliză; insuficienţă renală, oligurie, retenţie urinară; amenoree, scurgeri mamelonare, mărirea de volum a sânilor, ginecomastie; scădere a numărului de leucocite.
Foarte rare: insuficienţă hepatică; hepatită.
Supradozaj: cel mai frecvent raportate reacţii adverse au inclus somnolenţă, stare confuzională, agitaţie şi stare de nelinişte. Au fost raportate şi convulsii. Au fost raportate cazuri rare de comă. Tratamentul supradozajului cu pregabalin trebuie să includă măsuri generale de susţinere şi, dacă este necesar, poate include hemodializă.
Contraindicaţii: Hipersensibilitate la substanţa activă sau la oricare dintre excipienţi [(Lactoză monohidrat, Amidon de porumb, Talc, Gelatină, Dioxid de titan (E171), Laurilsulfat de sodiu, Dioxid de siliciu coloidal anhidru, Shellac, Oxid negru de fer (E172), Propilenglicol, Hidroxid de potasiu, Oxid roşu de fer (E172)].
Referinţe:
- Rezumatul caractecteristicilor produsului Lyrica®
LYR-2023-1433
Eficacitate clinică
LYRICA® asigură ameliorarea rapidă și susținută a durerii neuropate periferice (DNeP).1-3
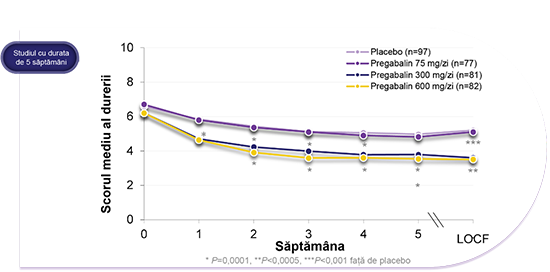
Îmbunătățirea scorurilor de durere pentru DNeP
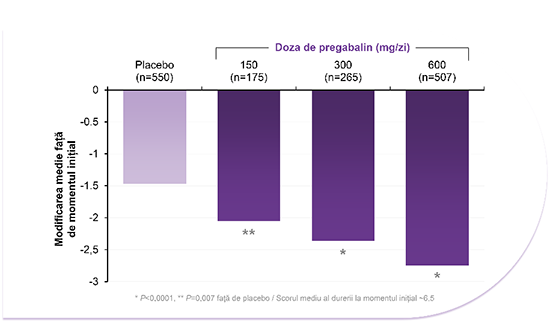
LYRICA® 300 mg/zi și 600 mg/zi au ameliorat durerea față de placebo începând chiar din prima săptămână de tratament, pe durata studiului de 5 săptămâni.4
Lesser H, Sharma U, LaMoreaux L, Poole R.M. Pregabalin relieves symptoms of painful diabetic neuropathy: A randomized controlled trial. Neurology. 2004
LOCF = extrapolare în sens longitudinal a ultimelor date (relevante) observate
*Un studiu randomizat, în regim dublu-orb, controlat cu placebo, cu durata de 5 săptămâni cu LYRICA® (pregabalin) în tratamentul neuropatiei periferice diabetice (NPD) dureroase (studiul 029/studiul DPN 1 în USPI). Pacienții au fost randomizați la și tratați cu LYRICA® 75 mg/zi (n=77), 300 mg/zi (n=81), 600 mg/zi (n=82) sau placebo (n=97), administrat într-o schemă de (administrare de 3x/zi (de trei ori pe zi). Pacienții din grupurile cu 75 mg/zi și 300 mg/zi au primit doza randomizată completă de la începutul studiului. Numerele de pacienți prezentate pe diapozitiv se referă la numărul de pacienți incluși în analiza pe baza intenției de tratament (ITT), extrapolare în sens longitudinal a ultimelor date (relevante) observate (LOCF) la criteriu final de evaluare. Modificările în timp se bazează pe analiza cazurilor observate (OC). Variabila primară de eficacitate a fost, pentru toate studiile privind durerea, scorul mediu al durerii aferent criteriului final de evaluare în fiecare grup cu LYRICA® în comparație cu placebo, pe baza scorurilor privind durerea din înregistrările în jurnal din ultimele 7 zile, în timp ce pacienții erau sub tratament. Au fost comparate, de asemenea, scorurile săptămânale medii.
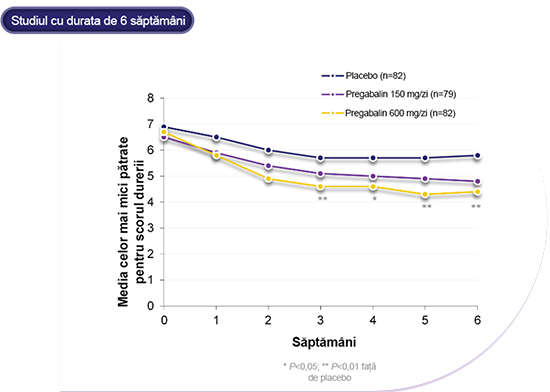
LYRICA® 600 mg/zi a fost semnificativ mai eficace la ameliorarea durerii decât placebo, începând chiar din a doua săptămână de tratament și pe durata studiului de 6 săptămâni.5
Richter RW, Portenoy R, Sharma U, LaMoreaux L, Brockbrader H, Knap LE. Relief of painful diabetic peripheral neuropathy with pregabalin: A randomized, placebo-controlled trial. J Pain. 2005
LOCF = extrapolare în sens longitudinal a ultimelor date (relevante) observate
*Un studiu randomizat, în regim dublu-orb, controlat cu placebo, cu durata de 6 săptămâni, cu LYRICA®(pregabalin) în tratamentul neuropatiei periferice diabetice (NPD) dureroase (studiul 014). Pacienții au fost randomizați la și tratați cu LYRICA® 150 mg/zi (n=79), 600 mg/zi (n=82) sau placebo (n=85), administrat într-o schemă de administrare de 3x/zi (de trei ori pe zi). Numerele de pacienți prezentate pe diapozitiv se referă la numărul de pacienți incluși în analiza pe baza intenției de tratament (ITT), extrapolare în sens longitudinal a ultimelor date (relevante) observate (LOCF) la criteriu final de evaluare. Modificările în timp se bazează pe analiza cazurilor observate (OC). Variabila primară de eficacitate a fost, pentru toate studiile privind durerea, scorul mediu al durerii aferent criteriului final de evaluare în fiecare grup cu LYRICA® în comparație cu placebo, pe baza scorurilor privind durerea din înregistrările în jurnal din ultimele 7 zile, în timp ce pacienții erau sub tratament. Au fost comparate, de asemenea, scorurile săptămânale medii.
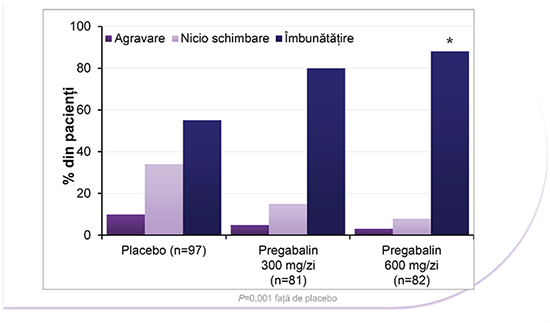
Eficacitatea în cazul DNeP: Impresia globală a pacientului privind schimbarea (PGIC)
LYRICA® 300 mg/zi și 600 mg/zi au îmbunătățit semnificativ impresia pacienților privind durerea4
Lesser H, Sharma U, LaMoreaux L, Poole R.M. Pregabalin relieves symptoms of painful diabetic neuropathy: A randomized controlled trial. Neurology. 2004
*Un studiu randomizat, în regim dublu-orb, controlat cu placebo, cu durata de 5 săptămâni cu LYRICA® (pregabalin) în tratamentul neuropatiei periferice diabetice (NPD) dureroase (studiul 029/studiul DPN 1 în USPI). Pacienții au fost randomizați la și tratați cu LYRICA® 75 mg/zi (n=77), 300 mg/zi (n=81), 600 mg/zi (n=82) sau placebo (n=97), administrat într-o schemă de administrare de 3x/zi (de trei ori pe zi). Pacienții din grupurile cu 75 și 300 mg/zi au primit doza randomizată completă de la începutul studiului. Numerele de pacienți prezentate pe diapozitiv se referă la numărul de pacienți incluși în analiza pe baza intenției de tratament (ITT), extrapolare în sens longitudinal a ultimelor date (relevante) observate (LOCF) la criteriu final de evaluare. Modificările în timp se bazează pe analiza cazurilor observate (OC). Variabila primară de eficacitate a fost, pentru toate studiile privind durerea, scorul mediu al durerii aferent criteriului final de evaluare în fiecare grup cu LYRICA® în comparație cu placebo, pe baza scorurilor privind durerea din înregistrările în jurnal din ultimele 7 zile, în timp ce pacienții erau sub tratament. Au fost comparate, de asemenea, scorurile săptămânale medii.
Îmbunătățirea semnificativă a somnului pentru pacienții cu DNeP la toate cele trei doze autorizate
Îmbunătățirea interferenței durerii asociate cu somnul, de la intrarea în studiu la momentul criteriului final de evaluare a fost semnificativ mai mare cu LYRICA® 150, 300 și 600 mg/zi decât cu placebo.6
A fost observată o îmbunătățire a calității somnului începând chiar din săptămâna 1, în 2 dintre studiile incluse în această analiză cumulativă 5, 7
Richter RW, Portenoy R, Sharma U, LaMoreaux L, Brockbrader H, Knap LE. Relief of painful diabetic peripheral neuropathy with pregabalin: A randomized, placebo-controlled trial. J Pain. 2005
Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo-controlled trial. Pain. 2004
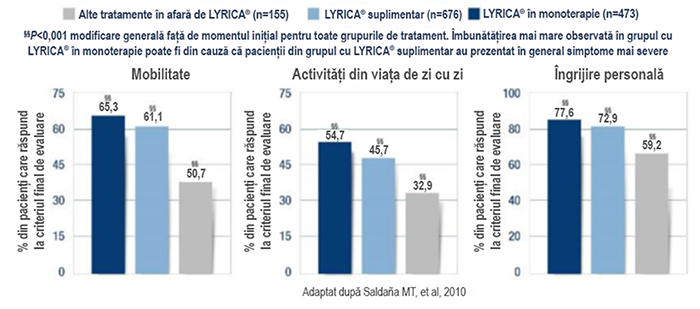
Pacienții cu radiculopatie prezintă o reducere semnificativă a durerii în urma tratamentului cu LYRICA® în condiţiile practicii medicale din lumea reală.8
Într-un studiu prospectiv, din lumea reală, de 12 săptămâni realizat de Saldaña MT, et al. (2010), LYRICA® a fost asociat cu o reducere semnificativă a durerii din cauza radiculopatiei lombare sau cervicale față de alte tratamente decât LYRICA® după 4 săptămâni de tratament.8
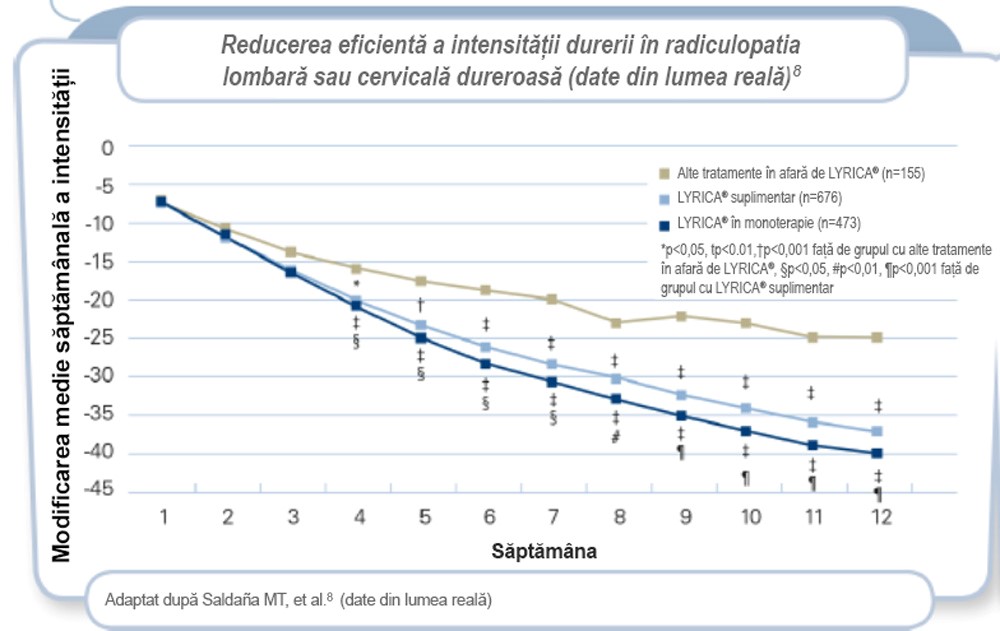
Reducerea mai mare a durerii observată în grupul cu monoterapie cu LYRICA® poate fi din cauză că pacienții din grupul cu tratament suplimentar cu LYRICA® au prezentat în general simptome mai severe.
Rezultatele unei analize secundare a unui studiu multicentric, observațional (naturalist) și prospectiv, cu durata de 12 săptămâni, efectuat la 1.304 pacienți cu radiculopatie dureroasă de origine cervicală sau lombosacrală, care nu au fost tratați anterior cu LYRICA® și au fost refractari la alte analgezice la intrarea în studiu. Majoritatea pacienților din grupul cu „alte tratamente decât LYRICA®” (67%) au luat două sau mai multe medicamente pentru tratamentul durerii.
Pacienții cu radiculopatie prezintă reduceri semnificative ale durerii și simptomelor asociate în condițiile practicii medicale din lumea reală cu LYRICA®8,9
LYRICA® îmbunătățește semnificativ caracterul adecvat al somnului, anxietatea și depresia la pacienții cu radiculopatie (în condițiile practicii medicale din lumea reală).8
Într-o analiză post-hoc a unui studiu observațional cu durata de 6 săptămâni, Toelle T, et al. (2012) au demonstrat că după 6 săptămâni de tratament cu LYRICA®:
- -Procentul de pacienți cu durere de spate cărora le-a fost afectat somnul din cauza durerii în manieră moderată până la severă a scăzut de la 81% la 21%.9
- -Procentul de pacienți cu dureri de spate care se simt calmi și relaxați a crescut de la 24% la 78%.9
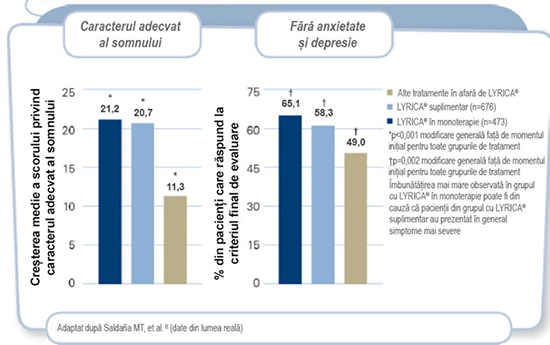
Reducerea mai mare a durerii observată în grupul cu monoterapie cu LYRICA® poate fi din cauză că pacienții din grupul cu tratament suplimentar cu LYRICA® au prezentat în general simptome mai severe.
Rezultatele unei analize secundare a unui studiu multicentric, observațional (naturalist) și prospectiv, cu durata de 12 săptămâni, efectuat la 1.304 pacienți cu radiculopatie dureroasă de origine cervicală sau lombosacrală, care nu au fost tratați anterior cu LYRICA® și au fost refractari la alte analgezice la intrarea în studiu. Majoritatea pacienților din grupul cu „alte tratamente decât LYRICA®” (67%) au luat două sau mai multe medicamente pentru tratamentul durerii.
Pacienții cu radiculopatie prezintă ameliorări semnificative în mai multe dimensiuni privind calitatea vieții cu LYRICA® în practicii medicale din lumea reală.8
LYRICA® îmbunătățește semnificativ mobilitatea, activitățile zilnice și îngrijirea personală, deoarece pacienții din grupul cu tratament suplimentar cu LYRICA® au prezentat în general simptome mai severe.8
Rezultatele unei analize secundare a unui studiu multicentric, observațional (naturalist) și prospectiv, cu durata de 12 săptămâni, efectuat la 1.304 pacienți cu radiculopatie dureroasă de origine cervicală sau lombosacrală, netratați anterior cu LYRICA®și refractari la alte analgezice la intrarea în studiu. Majoritatea pacienților din grupul cu „alte tratamente decât LYRICA®” (67%) au luat două sau mai multe medicamente pentru tratamentul durerii.
LYRICA® a ameliorat durerea și a fost bine tolerat la pacienții cu control suboptim al durerii în tratamentul în asociere.10
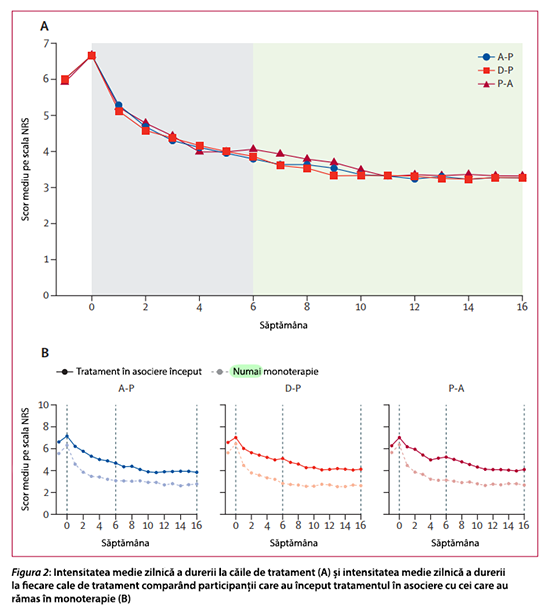
OPTION-DM a fost un studiu randomizat, în regim dublu-orb, încrucișat, desfășurat în mai multe centre din Regatul Unit. Studiul a inclus pacienți cu durere neuropată diabetică periferică (DNDP) care au avut un scor mediu pe scala numerică de evaluare a durerii zilnice (NRS) de 4 sau mai mare pe o scală de la 0 la 10.
Participanții au fost repartizați aleatoriu într-un raport de 1:1:1:1:1:1, utilizând un program de randomizare predeterminat care a fost stratificat în funcție de centru. Aceasta a implicat blocuri permutate de dimensiunea șase sau doisprezece. Participanții au fost alocați uneia dintre cele șase secvențe predefinite ale celor trei căi de tratament: amitriptilina suplimentată cu pregabalin (A-P), pregabalinul suplimentat cu amitriptilină (P-A) și duloxetina suplimentată cu pregabalin (D-P). Fiecare cale a durat 16 săptămâni. Monoterapia inițială a fost administrată timp de șase săptămâni și apoi a fost suplimentată cu medicație asociată dacă ameliorarea durerii a fost inadecvată (NRS >3), aliniată cu practicile clinice curente. Ambele tratamente au fost titrate la doza maximă tolerată (75 mg pe zi pentru amitriptilină, 120 mg pe zi pentru duloxetină și 600 mg pe zi pentru pregabalin). Rezultatul primar măsurat a fost diferența în ceea ce privește durerea zilnică medie pe 7 zile în ultima săptămână a fiecărei căi de tratament.
Media dozelor maxime tolerate pe zi și procentul de participanți la doza maximă în săptămâna 6 au fost de 56 mg (53 de participanți, 51%) pentru amitriptilină, 76 mg (46 de participanți, 46%) pentru duloxetină și 397 mg (59 de participanți, 55%) pentru pregabalin. În cazul tratamentelor asociate, media dozelor maxime tolerate pe zi și procentul de participanți la doza maximă de medicament de linia a doua în săptămâna 16 au fost de 347 mg (21 de participanți, 47%) pentru A-P, 405 mg (23 de participanți, 55%) pentru D-P și 52 mg (22 de participanți, 47%) pentru P-A.
În toate căile de tratament, reducerea medie a durerii a fost de 2,6 (IÎ 98,3% 2,2 până la 3,0) în săptămâna 6, reflectând efectul monoterapiei (n=299; p<0,0001) și 3,4 (2,9 până la 3,8) în săptămâna 16 (n=265; p<0,0001).
În total, 106 pacienți (35%) cu date disponibile privind rezultatele au obținut un răspuns la monoterapia maximă tolerată, atingând pe scala numerică de evaluare (NRS) un scor de 3 sau mai mic, care indică o durere ușoară.
În plus, 120 de pacienți (40%) au prezentat o reducere cu 50% față de nivelul inițial al durerii. În timpul celor 10 săptămâni ulterioare de tratament în asociere, încă 37 de pacienți (19%) au atins pe NRS un scor de 3 sau mai mic, ceea ce înseamnă o durere ușoară, iar 23 de pacienți (14%) au obținut o reducere cu 50% a durerii.
Evenimentele adverse determinate de tratament (EADT) au fost bine recunoscute pentru medicamentele de studiu prescrise în mod obișnuit. Amețeala a fost mai prevalentă în calea P-A (p=0,036), greața a fost mai frecventă în calea D-P (p=0,0011), iar senzația de gură uscată a fost mai frecventă în calea A-P (p=0,0003).
Majoritatea întreruperilor din cauza evenimentelor adverse determinate de tratament (EADT) au avut loc în faza de monoterapie. În mod specific, calea P-A a prezentat cea mai mică rată de întreruperi, cu cinci cazuri (5%) din 107, spre deosebire de A-P (11 cazuri [11%] din 104) și D-P (17 cazuri [17%] din 100; p=0,031).
Constatările din studiul OPTION-DM au indicat faptul că fiecare dintre cele trei căi de tratament (A-P, D-P și P-A) a condus la o reducere comparabilă și remarcabilă a durerii, în special o reducere de 3,3 pe scala numerică de evaluare (NRS), echivalentă cu jumătate din scorul intensității durerii de la intrarea în studiu.
OPTION-DM se remarcă drept cel mai extins studiu în regim orb privind durerea neuropată până în prezent, care a durat în total 50 de săptămâni. În această perioadă, fiecare pacient a parcurs toate cele trei căi de tratament.
Colectiv, acest studiu oferă o promisiune semnificativă de a influența formularea liniilor directoare de tratament pentru durerea neuropată diabetică periferică (DNDP).
Referinţe:
- Freynhagen R, Strojek K, Griesing, T, Whalen E, Balkenohl, Me. Efficacy of pregabalin in neuropathic pain evaluated in a 12-week, randomised, double-blind, multicentre, placebo-controlled trial of flexible- and fixed-dose regimens. Pain. 2005;115(3):254-263.
- Sharma U, et al. Time to onset of neuropathic pain reduction: A retrospective analysis of data from nine controlled trials of pregabalin for painful diabetic peripheral neuropathy and postherpetic neuralgia. Am J Ther. 2010;17(6):577-585.
- Stacey BR, Dworkin RH, Murphy K, Sharma U, Emir B, Griesing T. Pregabalin in the treatment of refractory neuropathic pain: results of a 15-month open-label trial. Pain Med. 2008;9(8):1202-1208.
- Lesser H, Sharma U, LaMoreaux L, Poole R.M. Pregabalin relieves symptoms of painful diabetic neuropathy: A randomized controlled trial. Neurology. 2004;63(11):2104-2110.
- Richter RW, Portenoy R, Sharma U, LaMoreaux L, Brockbrader H, Knap LE. Relief of painful diabetic peripheral neuropathy with pregabalin: A randomized, placebo-controlled trial. J Pain. 2005;6(4):253-260.
- Freeman R, Durso-DeCruz E, Emir B. Efficacy, safety, and tolerability of pregabalin treatment for painful diabetic peripheral neuropathy. Diabetes Care. 2008;31(7):1448-1454.
- Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo-controlled trial. Pain. 2004;110:628-638.
- Saldaña M, Navarro A. Patient-reported-outcomes in subjects with painful lumbar or cervical radiculopathy treated with pregabalin: evidence from medical practice in primary care settings. Rheumatol Int. 2010;30(8):1005-1015.
- Toelle TR, Varvara R. Pregabalin in neuropathic pain related to DPN, cancer and back pain: analysis of a 6-week observational study. Open Pain J. 2012;5:1-11.
- Tesfaye, Solomon, et al. "Comparison of amitriptyline supplemented with pregabalin, pregabalin supplemented with amitriptyline, and duloxetine supplemented with pregabalin for the treatment of diabetic peripheral neuropathic pain (OPTION-DM): a multicentre, double-blind, randomised crossover trial." *Names of all contributing authors,* OPTION-DM trial group.
LYR-2023-1433
Ghiduri şi recomandări internaţionale
Tratamentul durerii neuropate este dificil, iar pacienții cu durere neuropată primesc adesea un tratament necorespunzător sau inadecvat, ceea ce face ca recomandările de tratament bazate pe dovezi să fie esențiale pentru această populație.
Pe baza calității ridicate a dovezilor și a eficacității în studiile clinice, ghidurile NeuPSIG (Grupul special de interes pentru durerea neuropată, din cadrul Asociației Internaționale pentru Studiul Durerii - IASP), recomandă ferm pregabalinul pentru tratamentul durerii neuropate, iar ghidul EFNS (Federația Europeană a Societăților Neurologice), cât și ghidul NeuPSIG recomandă pregabalinul ca tratament de primă linie pentru durerea neuropată.1,2
Lyrica (pregabalin) este recomandat ca tratament de primă linie pentru durerea neuropată periferică și centrală, inclusiv polineuropatia diabetică dureroasă, nevralgia post-herpetică și afecțiunile cu durere neuropată centrală.1,2
LYRICA® este recomandat ca tratament de primă linie pentru DNe de către principalele ghiduri internaționale.

LYRICA® este recomandat ca tratament de primă linie pentru gestionarea durerii neuropatice diabetice periferice de către principalele ghiduri internaționale.6

Referinţe:
- Attal N, Cruccu G, Baron R, Haanpaa M, Hansson P, et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Euro J Neurol. 2010;17:1113-1123.
- Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015;14:162-173.
- Neuropathic pain in adults: pharmacological management in non-specialist settings. NICE Guidance. https://www.nice.org.uk/guidance/CG173. Accessed August 19, 2021.
- Schlereth T. Guideline “diagnosis and non interventional therapy of neuropathic pain” of the German Society of Neurology (deutsche Gesellschaft für Neurologie). Neurol Res Pract. 2020;2(1):16.
- Mu A et al Pharmacologic management of chronic neuropathic pain, Review of the Canadian pain society consensus statement, Canadian Family Physician 2017; 63:844-852.
- Azmi S, ElHadd KT, Nelson A, et al. Pregabalin in the management of painful diabetic neuropathy: a narrative review. Diabetes Ther. 2019;10(1):35-56.
- Price R et al. Oral and topical treatment of pDPN: Practice guideline Update Summary. Neurology 2022; 98(1):31-43, DOI: 10.1212/WNL.0000000000013038.
- ADA's Primary CarGroup (PCAG), Standards of care in Diabetes 2021, Clinical Diabetes Journal 2021; 39(1),
www.clinical.diabetesjournal.org. - Handelsman Y, Bloomgarden ZT, Grunberger G, et al. American association of clinical endocrinologists and american college of endocrinology - clinical practice guidelines for developing a diabetes mellitus comprehensive care plan-2015. Endocr Pract. 2015;21 Suppl 1(Suppl 1):1-87. 10.
- Attal N, Cruccu G, Baron R, et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Eur J Neurol. 2010;17(9):1113-e88
LYR-2023-1433
Rezumatul Caracteristicilor Produsului
LYR-2023-1433
Lyrica® - 20 de ani de experienţă clinică
De 20 de ani, Lyrica® le permite pacienților să redescopere frumusețea momentelor în fiecare zi, să-și urmeze pasiunile și să adopte o viață plină de vitalitate.1
Cu o experienţă de peste 53 de milioane de pacienţi-ani, Lyrica® a transformat viaţa pacienților care se confruntă cu durere neuropată, neuropatie periferică diabetică dureroasă, epilepsie și tulburare de anxietate generalizată, ajutându-i să obțină o calitate mai bună a vieții.2
Celebrăm 20 de ani de LYRICA® și continuăm să
fim dedicați misiunii noastre de a îmbunătăți calitatea
vieții pacienților!
Urmăriți video-ul aniversar LYRICA® 20 de ani
Vă mulțumim pentru încredere!

Referinţe:
- LYRICA® - Rezumatul Caracteristicilor Produsului.
- Finnerup NB, et al. Lancet Neurol. 2015;14(2):162-173.
- NICE Guidelines 2013. Available at: https://www.nice.org.uk/guidance/cg173/resources/neuropathic- pain-in-adults-pharmacological-management-in-nonspecialist-settings-pdf-35109750554053.
RO-LYR-2025-00003
V-ar putea interesa şi:
Dislipidemia - factor de risc cardiovascular
Dislipidemia - factor de risc cardiovascular
Ghidul ESC/EAS 2019 pentru managementul dislipidemiilor
Ghidul European de management al dislipidemiilor 2019
Beneficii terapeutice la pacienţii cu diabet zaharat

Sortis - beneficii terapeutice la pacienţii cu DZ
Ghidul ESC 2021 de prevenție a bolilor cardiovasculare în practica clinică
Ghidul European de preventie a bolilor cardiovasculare in practica clinica 2021